Bách khoa toàn thư phanh Wikipedia
Đừng lầm lẫn với amino axit Alanin.
Bạn đang xem: anilin có làm đổi màu quỳ tím không
| Anilin | |||
|---|---|---|---|
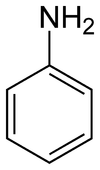 
| |||
| Tổng quan | |||
| Tên khác | Phenylamin Aminobenzen Benzenamin | ||
| Số CAS | [62-53-3] | ||
| Công thức hóa học | C6H7N | ||
| SMILES | NC1=CC=CC=C1 | ||
| Khối lượng phân tử | 93,13 g/mol | ||
| Bề ngoài | chất lỏng ko màu | ||
| Thuộc tính | |||
| Tỷ trọng và pha | 1,0217 g/ml, lỏng | ||
| Độ hoà tan nhập ethanol, aceton | có thể hoà tan | ||
| Nhiệt nhiệt độ chảy | - 6,3 °C | ||
| Nhiệt phỏng sôi | 184,13 °C | ||
| Độ hoà tan nhập nước | 3,6 g/100 ml ở 20 °C | ||
| Hằng số axit (pKa) | 4.87 | ||
| Hằng số base (pKb) | 9.4202 | ||
| Độ nhớt | 3,71 cP ở 25 °C | ||
| Dữ liệu sức nóng động | |||
| Entanpy cháy ΔcH |
-3394 kJ/mol | ||
| Nguy hiểm | |||
| MSDS | MSDS ngoài | ||
| Phân loại của EU | Độc (T) Gây ung thư Gây đột vươn lên là gen Nguy hiểm với môi trường | ||
| NFPA 704 |
| ||
| Nguy hiểm | R23/24/25, R40, R41, R43, R48/23/24/25, R68, R50 | ||
| An toàn | S1/2, S26, S27, S36/37/39, S45, S46, S61, S63 | ||
| Dữ liệu té sung | |||
| Cấu trúc và tính chất |
n, εr, v.v.. | ||
| Tính chất nhiệt động |
Pha Rắn, lỏng, khí | ||
| Anilin (dữ liệu)#Phổ | UV, IR, NMR, MS | ||
| Hóa hóa học liên quan | |||
| Amin thơm tho liên quan | 1-Naphthylamin 2-Naphthylamin | ||
| Hợp hóa học liên quan | Phenylhydrazin Nitrosobenzen Nitrobenzen | ||
| Ngoại trừ đem thông tin không giống, những dữ liệu được lấy ở 25 °C, 100 kPa Thông tin cẩn về việc lắc đầu và tham lam chiếu | |||
Anilin (bắt mối cung cấp kể từ từ giờ đồng hồ Pháp aniline /anilin/),[1] còn được viết lách là a-ni-lin,[1] cũng còn được gọi là phenyl amin hoặc amino benzen là thích hợp hóa học cơ học nằm trong sản phẩm đồng đẳng amin với công thức phân tử C6H7N. Nó là 1 trong trong mỗi amin thơm tho giản dị nhất và cần thiết nhất. Ứng dụng đa số của chính nó là nhằm phát triển PU (poly ure). Giống như các amin thơm tho không giống, nó đem mùi hương không dễ chịu của cá ươn. Anilin không nhiều tan nội địa (trừ Khi đun sôi), Khi chão nhập domain authority sẽ gây ra phỏng rát. Cồn, xăng, dầu chiên đơn giản và dễ dàng hòa tan anilin bởi vậy nhằm xử lý những anilin bị ụp, người tớ sử dụng hễ hoặc xăng. Anilin cũng là 1 trong độc hại đem mùi hương xốc. Nó cháy đơn giản và dễ dàng tạo nên sương.
Cấu trúc[sửa | sửa mã nguồn]
Bao bao gồm một group phenyl links với cùng 1 group amin. Anilin là 1 trong phân tử tương đối hình tháp, với việc lai tạp của nitơ ở nơi nào đó thân thiện sp 3 và sp 2 . Kết trái ngược là, cặp nitơ đơn độc nằm trong một orbital lai hóa sp x với đặc điểm p cao. Nhóm amino nhập anilin phẳng phiu rộng lớn (ví dụ, nó đem dạng "hình tháp nông hơn") đối với group amino nhập amin bự, tự sự phối hợp của cặp đơn với group thế aryl . Hình học tập để ý được phản ánh một thỏa hiệp thân thiện nhị nguyên tố cạnh tranh: 1) ổn định lăm le của cặp e N nhập một quy trình với anh hùng cần thiết của thiên pyramidalization (quỹ đạo với s anh hùng thấp về năng lượng), trong những lúc 2) delocalization của N cặp đơn lẻ nhập vòng aryl tạo nên sự thuần nhất (một cặp đơn lẻ nhập một quy trình p đơn thuần tạo nên sự xen phủ tốt nhất có thể với những obitan của khối hệ thống vòng π của benzen). [7]
Phù phù hợp với những nguyên tố này, những anilin được thay cho thế vì chưng những group mang đến năng lượng điện tử đem hình chóp rộng lớn, trong những lúc những anilin đem group rút năng lượng điện tử tiếp tục phẳng phiu rộng lớn. Tại anilin u, cặp đơn lẻ đem ký tự động xấp xỉ 12% s, ứng với luật lệ lai sp 7.3 . [7] (Để đối chiếu, những ankylamin thông thường đem những cặp đơn lẻ trong số orbital sát với sp 3. )
Góc hình chóp thân thiện links C – N và phân giác của góc H – N – H là 142,5 °. [8] (Để đối chiếu, nhập metylamin hình tháp mạnh rộng lớn, độ quý hiếm này là ~ 125 °, trong những lúc nitơ phẳng phiu như của formamit đem góc 180 °.) Khoảng cơ hội C – N cũng ngắn thêm một đoạn ứng. Trong anilin, phỏng nhiều năm links C – N là một trong những,41 Å, [9] sánh với cùng 1,47 Å so với xyclohexylamin, [10] đã cho chúng ta biết links π 1 phần thân thiện N và C. [11]
Điều chế[sửa | sửa mã nguồn]
Đầu tiên, benzen được nitrat hoá vì chưng láo lếu thích hợp đậm quánh axit nitric và axit sunfuric ở 50-60 °C, tạo nên nitrobenzen:
Đây là 1 trong trong mỗi tiến độ phát triển gian nguy nhất tự phản xạ toả sức nóng mạnh, rất có thể làm cho nổ.
Tiếp theo đuổi, nitrobenzen được gửi hoá trở nên anilin:
Các hóa học xúc tác chủ yếu được dùng là những sắt kẽm kim loại group 10 như nickel, palladium và platin.
Ngoài đi ra, anilin rất có thể được pha chế Theo phong cách không giống kể từ amoniac và phenol đem xuất xứ kể từ cumene .
Xem thêm: ai là người đặt tên cho dòng sông
Tính chất[sửa | sửa mã nguồn]
Oxi hoá[sửa | sửa mã nguồn]
Anilin oxi hoá chậm rì rì nhập không gian, tạo nên những vết gray clolor đen thui.
Tính base[sửa | sửa mã nguồn]
Anilin là 1 trong base yếu đuối. Những amin thơm tho như anilin đem tính base yếu đuối rộng lớn amoniac. Anilin đặc biệt không nhiều tan nội địa tuy nhiên nước hâm sôi rất có thể hòa tan được anilin. Dung dịch của chính nó ko thực hiện thay đổi color quỳ tím.
Tính hóa học của vòng benzen[sửa | sửa mã nguồn]
Do phân tử đem group -NH2 nên tỷ lệ electron của vòng benzen cao hơn nữa đối với benzen. Do cơ, Khi tiến hành phản xạ thế thì 2 địa điểm ortho và para(so với group -NH2) sẽ tiến hành ưu tiên thế và phản xạ ra mắt khá đơn giản và dễ dàng.
Tính hóa học của tập thể nhóm amin[sửa | sửa mã nguồn]
Anilin phản xạ với acid nitrogen ở sức nóng phỏng thấp (0-5 phỏng C) sinh đi ra những thích hợp hóa học diazoni
C6H5NH2 + HONO -> C6H5N2+Cl- + 2H2O
Các thích hợp hóa học diazoni lại là chi phí hóa học phát triển dung dịch nhuộm azo. Do cơ, một lượng rộng lớn anilin được phát triển nhằm là vật liệu phát triển những loại thuốc chữa bệnh nhuộm không giống.
Anilin cũng có thể có tài năng phản xạ với những alcohol. Đây được gọi là phản xạ Friedel- Craft.
C6H5NH2 + 2CH3OH → C6H5N(CH3)2 + 2H2O
C6H5NH2 + CH3OH → C6H5NHCH3+ H2O
Xem thêm: ngày xuân con én đưa thoi
Anilin cũng rất có thể phản xạ thẳng với những dẫn xuất halogen, cũng chiếm được những thích hợp hóa học amin bậc nhị hoặc bậc tía. Sau cơ, NaOH/KOH sẽ tiến hành dùng nhằm tách acid halogenic thoát ra khỏi láo lếu thích hợp.
Ứng dụng[sửa | sửa mã nguồn]
Phần rộng lớn anilin được dùng làm phát triển metylendianilin. Trong khi, bọn chúng còn được dùng làm phát triển dung dịch nhuộm, chế vươn lên là cao su đặc, phát triển polime, dung dịch chữa trị dịch....
Một lượng rộng lớn anilin được dùng làm phát triển 4,4′-Methylenedianiline ( MDA ) tuy nhiên chủ yếu này lại được dùng làm phát triển Auramine O.
Tham khảo[sửa | sửa mã nguồn]
- ^ a b Đặng Thái Minh, "Dictionnaire vietnamien - français. Les mots vietnamiens d’origine française", Synergies Pays riverains du Mékong, n° spécial, năm 2011. ISSN: 2107-6758. Trang 49.
Liên kết ngoài[sửa | sửa mã nguồn]
- Avogadro savety sheet Lưu trữ 2006-10-04 bên trên Wayback Machine
- Acros savety sheet
- International Chemical Safety Card 0011
- National Pollutant Inventory - Aniline Lưu trữ 2006-09-10 bên trên Wayback Machine
- NIOSH Pocket Guide vĩ đại Chemical Hazards
- IARC Monograph "Aniline" Lưu trữ 2005-10-12 bên trên Wayback Machine
- Computational Chemistry Wiki entry Lưu trữ 2007-09-27 bên trên Wayback Machine
- Aniline electropolymerisation













.png)
Bình luận