Công thức tính Xác Suất khối lượng là một trong những trong mỗi kỹ năng và kiến thức cơ phiên bản nhập công tác Hóa học tập trung học cơ sở, trung học phổ thông.
Cách tính Xác Suất lượng tuy nhiên Download.vn tiếp tục trình làng nhập bài học kinh nghiệm thời điểm ngày hôm nay bao gồm toàn cỗ kỹ năng và kiến thức về lý thuyết, công thức tính phần trăm khối lượng chất hóa học, phương pháp tính tỉ số lượng của những thành phần nhập thích hợp hóa học, tính lượng của thành phần đem nhập một lượng hóa học đang được biết tất nhiên ví dụ minh họa và những dạng bài bác tập luyện đem đáp án. Qua cơ hùn chúng ta học viên lớp 9 tìm hiểu thêm, khối hệ thống lại kỹ năng và kiến thức nhằm giải thời gian nhanh những bài bác tập luyện Hóa học tập 9. Dường như chúng ta coi tăng Cách phân biệt Oxit axit và Oxit bazơ.
Bạn đang xem: công thức tính phần trăm khối lượng
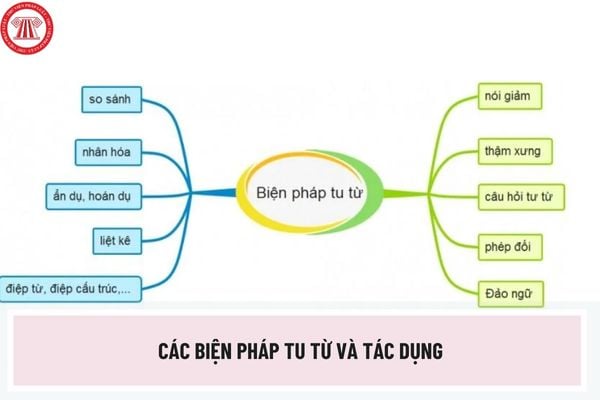
1. Phần trăm lượng là gì?
Phần trăm lượng tiếp tục cho thấy thêm tỷ trọng Xác Suất của từng thành phần nhập thích hợp Hóa chất.
Muốn tìm hiểu Xác Suất lượng thì tao nên biết lượng mol của những thành phần nhập thích hợp hóa học theo gót gam/mol hay những số gam của những hóa học tạo ra trở thành hỗn hợp.
Phần trăm lượng được xem với 1 công thức đơn giản và giản dị, này là lấy lượng của thành phần (hay hóa học tan) phân chia cho tới lượng của thích hợp hóa học (hay dung dịch).
2. Công thức tính Xác Suất lượng hóa học
Khi biết công thức của thích hợp hóa học đang được cho tới học viên hoàn toàn có thể tính bộ phận Xác Suất phụ thuộc lượng của những thành phần nhập thích hợp hóa học cơ với những bước sau:
Bước 1: Tính lượng mol của thích hợp hóa học AxBy:
Bước 2: Tính số mol nguyên vẹn tử của từng thành phần đem chứa chấp trong một mol thích hợp hóa học AxBy. 1 mol phân tử AxBy có: x mol nguyên vẹn tử A và hắn mol nguyên vẹn tử B.
- Tính lượng những thành phần chứa chấp trong một mol thích hợp hóa học AxBy.
mA = x.MA
mB = hắn.MB
- Thực hiện tại tính Xác Suất theo gót lượng của từng thành phần theo gót công thức:

Hoặc %mB = 100% - %mA
Hoặc %mB = 100% - %mA
Lưu ý: Công thức bên trên hoàn toàn có thể không ngừng mở rộng cho những thích hợp hóa học đem 3,4,... thành phần.
Ví dụ 1: Tính bộ phận % về lượng của thành phần Al nhập nhôm oxit Al2O3
Gợi ý đáp án
Ta có: Al = 27 => MAl = 27 g
Al2O3 = 2.27 + 3.16 = 102 => MAl 2 O 3 = 102 g
%mAl = 2.27/102.100% = 52,94%
Ta đem tể tính luôn luôn được % lượng của oxi đem trong
Al2O3 = 100% - 52,94% = 47,06%
Ví dụ 2: Xác quyết định bộ phận Xác Suất theo gót lượng của những thành phần đem nhập thích hợp hóa học KNO3
Gợi ý đáp án:
Khối lượng mol của thích hợp chất: MKNO3 = 39 + 14 + 16.3 = 101 gam/mol
Trong 1 mol KNO3 có: 1 mol nguyên vẹn tử K; 1 mol nguyên vẹn tử N và 3 mol nguyên vẹn tử O
Thành phần Xác Suất theo gót lượng của những thành phần là:
%mK = 39.100%/101 = 36,8%
%mN = 14.100%/101= 13,8%
%mO = 16.3.100%/101= 47,6% hoặc %mO = 100% - (36,8% + 13,8%) = 47,6%
3. Tính tỉ số lượng của những thành phần nhập thích hợp chất
Từ công thức chất hóa học đang được cho tới AxBy tao hoàn toàn có thể lập được tỉ số lượng của những nguyên vẹn tố:
mA : mB = x.MA : hắn.MB
Ví dụ: Xác quyết định tỉ số lượng của những thành phần cacbon và hidro nhập khí C2H4
Gợi ý đáp án
Ta có: C = 12.2 = 24 gam
H = 4.1 = 4
Trong 1 mol C2H4 đem 2 nguyên vẹn tử C, 4 nguyên vẹn tử H
mC : mH = 2.12 : 4.1 = 24 : 4 = 6: 1
Lưu ý: Nếu đang được biết bộ phận % về lượng của những thành phần thì lập tỉ số theo gót tỉ lệ thành phần bộ phận % nà, ví dụ như: Fe2O3 phía trên tao được %mFe = 70% và %mO = 30%. Khi cơ mFe : mO = 7:3
4. Tính lượng của thành phần đem nhập một lượng hóa học đang được biết
Nếu đem m là lượng của một thích hợp hóa học đang được biết đem CTHH là AxBy tao hoàn toàn có thể tính mA là lượng của thành phần A theo gót công thức sau:

Ví dụ: Tính lượng của thành phần đem nhập 8 g muối hạt đồng sunfat CuSO4
Gợi ý đáp án
Ta có: CuSO4 = 64 + 32 + 64 = 160 => MCuSO 4 = 160 g
![]()
5. Công thức tính bộ phận Xác Suất khối lượng
Cách 1.
+ Tìm lượng mol của thích hợp chất
+ Tìm số mol nguyên vẹn tử từng thành phần trong một mol thích hợp hóa học rồi quy về khối lượng
+ Tìm bộ phận Xác Suất những thành phần nhập thích hợp chất
Cách 2. Xét công thức hóa học: AxByCz
![]()
Hoặc %C = 100% - (%A + %B)
Ví dụ: Photphat ngẫu nhiên là phân lân ko qua quýt chế biến đổi học tập, bộ phận đó là can xi photphat đem công thức chất hóa học là Ca3(PO4)2
Gợi ý đáp án
Bước 1: Xác quyết định lượng mol của thích hợp hóa học.
MCa 3 (PO 4 ) 2 = 40.3 + 31.2 + 16.4.2 = 310 g/mol
Bước 2: Xác quyết định số mol nguyên vẹn tử của từng nguyên vẹn tó trong một mol thích hợp chất
Trong 1 mol Ca3(PO4)2 có: 3 mol nguyên vẹn tử Ca, 2 mol nguyên vẹn tử Phường và 8 mol nguyên vẹn tử O
Bước 3: Tính bộ phận % của từng thành phần.
6. Lập công thức chất hóa học của thích hợp hóa học lúc biết bộ phận Xác Suất (%) về khối lượng
Các bước xác lập công thức chất hóa học của thích hợp chất
+ Cách 1: Tìm lượng của từng thành phần đem trong một mol thích hợp hóa học.
+ Cách 2: Tìm số mol nguyên vẹn tử của thành phần đem trong một mol thích hợp hóa học.
+ Cách 3: Lập công thức chất hóa học của thích hợp hóa học.

Ví dụ: Một thích hợp hóa học khí đem bộ phận % theo gót lượng là 82,35%N và 17,65% H. Xác quyết định công thức chất hóa học của hóa học cơ. sành tỉ khối của thích hợp hóa học khí với hidro bởi vì 8,5.
Gợi ý đáp án
Khối lượng mol của thích hợp hóa học khí bằng: M = d, MH 2 = 8.5,2 = 17 (gam/mol)
![]()
Số mol nguyên vẹn tử của từng thành phần trong một mol thích hợp chất:
![]()
Trong 1 phân tử thích hợp hóa học khí bên trên có: 1mol nguyên vẹn tử N và 3 mol nguyên vẹn tử H.
Công thức chất hóa học của thích hợp hóa học bên trên là NH3
7. Tính Xác Suất lượng lúc không biết khối lượng
Bước 1: Xác quyết định phương trình tính Xác Suất lượng nhập thích hợp chất
- Viết phương trình Khi chính thức giải bài bác toán: Xác Suất lượng = (khối lượng mol nguyên vẹn tố/khối lượng phân tử của thích hợp chất) x 100.
- Đơn vị của nhì độ quý hiếm bên trên là gam bên trên mol (g/mol).
- Khi đề bài bác ko cho tới lượng, bạn cũng có thể dùng lượng mol nhằm tính Xác Suất lượng của thành phần.
Bước 2: Viết công thức hóa học
- Nếu đề bài bác ko cho tới công thức chất hóa học của từng thích hợp hóa học, tất cả chúng ta rất cần phải viết lách bọn chúng đi ra.
- Nếu đề bài bác cho tới công thức chất hóa học thì bỏ dở công đoạn này và gửi cho tới bước “Tìm lượng của từng nguyên vẹn tố”.
Bước 3: Tìm lượng của từng thành phần nhập thích hợp hóa học.
- Tra trọng lượng phân tử của từng thành phần nhập công thức chất hóa học bên trên bảng tuần hoàn
- Khối lượng thành phần thông thường được viết lách bên dưới ký hiệu chất hóa học.
- Viết đi ra lượng của từng thành phần nhập thích hợp hóa học.
Bước 4: Nhân nguyên vẹn tử khối với tỷ số mol.
- Xác quyết định số mol (tỷ số mol) của từng thành phần nhập thích hợp Hóa chất.
- Tỷ số mol được xem bởi vì số lượng nhỏ bên dưới nhập công thức chất hóa học của thích hợp hóa học. Nhân nguyên vẹn tử khối của từng thành phần với tỷ số mol.
Bước 5: Tính lượng tổng của thích hợp hóa học.
- Cộng lượng của toàn bộ thành phần nhập thích hợp hóa học.
- Có thể tính lượng tổng của thích hợp hóa học trải qua những lượng được xem theo gót tỷ số mol. Con số này được xem là kiểu số nhập phương trình Xác Suất lượng.
Bước 6: Xác quyết định lượng thành phần cần thiết tính Xác Suất lượng.
- Khi đề bài bác đòi hỏi tìm hiểu “phần trăm khối lượng”, tức thị chúng ta cần tìm hiểu lượng của một thành phần rõ ràng nhập thích hợp hóa học theo gót tỷ trọng Xác Suất với tổng lượng của toàn bộ những thành phần.
- Xác quyết định và viết lách đi ra lượng của thành phần cơ. Khối lượng này là lượng được xem theo gót tỷ số mol. Số này đó là tử số nhập phương trình Xác Suất lượng.
Bước 7: Thay những trở nên số nhập phương trình Xác Suất lượng.
Sau Khi xác lập giá tốt trị của từng trở nên số, chỉ việc thay cho chúng nó vào phương trình được xác lập nhập bước đầu tiên tiên:
Phần trăm lượng = (khối lượng mol nguyên vẹn tố/khối lượng phân tử của thích hợp chất) x 100.
Bước 8: Tính Xác Suất lượng.
Bây giờ phương trình đã và đang được điền lênh láng, chúng ta chỉ việc tính Xác Suất lượng.
Lấy lượng của thành phần phân chia cho tới tổng lượng thích hợp hóa học, rồi nhân với 100. Đây đó là Xác Suất lượng của thành phần nhập thích hợp hóa học.
8. Ví dụ công thức tính phần trăm khối lượng
Ví dụ 1: Tính bộ phận Xác Suất theo gót lượng của những thành phần nhập thích hợp hóa học sau:
a) SO2
b) Fe2(SO4)3
Gợi ý đáp án
a) MSO 2 = 32 +16.2 = 64
1 mol SO2 có một mol S và 2 mol O
% S = mS/mSO 2 .100%= 32/64.100% = 50%
% O = 100% - %m S= 100% - 50% = 50%
b) MFe2(SO4)3 = 56.2 + (32+16.4).3 = 400
1 mol Fe2(SO4)3 đem chứa chấp 2 mol Fe, 12 mol O, 3 mol S
% mFe= mFe/400.100% = 56/400.100% = 28%
% mS= mS/400.100% = 24%
% mO= mO/400.100% = 48%
Ví dụ 2: Một loại phân bón chất hóa học đem bộ phận đó là KNO3 (K = 39; N = 14; O=16). Hãy tính phần trăm: %mK = ?; %mN = ?; %mO = ?
Gợi ý đáp án
+ Tính lượng Mol (M) của thích hợp hóa học : MKNO3= 39 +14 + (3.16) = 101
+ Trong 1 mol KNO3: có một mol nguyên vẹn tử K; 3 mol nguyên vẹn tử O; 1 mol nguyên vẹn tử N
(Nói cách tiếp nhập 101g KNO3: đem 39 g K; 14 g N và 3.16 g O)
+ Tính bộ phận Xác Suất những thành phần đem nhập thích hợp hóa học Fe2(SO4)3
Xem thêm: ai là người đặt tên cho dòng sông
%mO ≈ 100% - (38,6% + 13,8%) = 47,6%
9. Bài tập luyện công thức tính phần trăm khối lượng
Bài 1: Tính bộ phận % lượng những thành phần đem nhập thích hợp hóa học sau:
a) NaCl
b) Al2O3
c) H2SO4
d) K2CO3
Gợi ý đáp án
a) NaCl
Khối lượng mol của hóa học đang được cho: MNaCl = 23 + 35,5 = 58,5 g
Thành phần Xác Suất (theo khối lượng) của những thành phần đem nhập thích hợp chất
%Na = (23.100)/58,5 = 39,32 %
%Cl = (35,5.100)/58,5 = 60,68%
b) Al2O3
Khối lượng mol của hóa học đang được cho: MAl2O3 = 23.2+16.3 = 102
Thành phần Xác Suất (theo khối lượng) của những thành phần đem nhập thích hợp chất
%Al = (27.2.100)/102 = 52,94%
%O = (16.3.100)/102 = 47,06%
c) H2SO4
Khối lượng mol của hóa học đang được cho: MH2SO4= 1. 2 + 32 + 16 . 4 = 98g
Thành phần Xác Suất (theo khối lượng) của những thành phần đem nhập thích hợp chất
%H = (1.2.100)/98 = 2,04%
%S = (32.100)/98 = 32,65%
%O = (16.4.100)/98 = 65,31%
d) Khối lượng mol của hóa học đang được cho: MK2CO3= 39 . 2 + 16 . 3 = 138g
Thành phần Xác Suất (theo khối lượng) của những thành phần đem nhập thích hợp chất
%K = (39.2 .100)/138 = 56,5 %
%C = (12.100)/138 = 8,7%
%O = (16.3 . 100)/138 = 34,8%
Bài 2: Một thích hợp hóa học đem công thức chất hóa học C6H12O6. Hãy cho tới biết:
a) Khối lượng mol của thích hợp hóa học đang được cho tới.
b) Thành phần Xác Suất theo gót lượng của những thành phần đem nhập thích hợp hóa học.
Gợi ý đáp án
Khối lượng mol của hóa học đang được cho: MC6H12O6 = 12.6 + 1.6 + 16.6 = 174
Thành phần Xác Suất (theo khối lượng) của những thành phần đem nhập thích hợp chất
%C = (12.6.100)/174 = 41,38%
%H = (1.12.100)174 = 6,9%
%O = 100% - 41,38% - 6,9% = 51,72%
Bài 3: Để tăng năng suất cho tới cây cỏ, một dân cày cho tới siêu thị phân bón để sở hữ phân đạm. Cửa sản phẩm đem những loại phân đạm như sau: NH4NO3 (đạm 2 lá), (NH2)2CO (ure), (NH4)2SO4 (đạm 1 lá)? Theo em, nếu như bác bỏ dân cày mua sắm 500kg phân đạm thì nên chọn mua loại phân này là chất lượng nhất?
Gợi ý đáp án
Tính dung lượng bộ phận % lượng của Nito trong số thích hợp chất

Vậy thì hoàn toàn có thể thấy dung lượng N nhập phân ure CO(NH2)2 là cao nhất
Bài 4: Trong những thích hợp hóa học sau, thích hợp hóa học này đem dung lượng Cu cao nhất: CuO, Cu2O, CuSO4.5H2O, Cu(OH)2, CuCl2?
Đáp án
Cu2O
Bài 5: So sánh bộ phận Xác Suất lượng Fe đem nhập 2 loại quặng sau: quặng Inmenit FeTiO3 và quặng Hematit Fe2O3.
Gợi ý đáp án
Quặng Inmenit đem %Fe = .100% = 36,84%
Quặng hematit đem %Fe = .100% = 70%
ð Quặng Hematit đem bộ phận Xác Suất lượng Fe nhiều hơn nữa đối với quặng Inmenit
Bài 6: Một người thực hiện vườn đang được người sử dụng 250 gam NH4NO3 nhằm bón rau củ.
a) Tính trở thành phân Xác Suất của thành phần đủ dinh dưỡng nhập phân bón.
b) Tính lượng của thành phần đủ dinh dưỡng bón cho tới ruộng rau củ.
Gợi ý đáp án
a) Thành phần Xác Suất lượng của N nhập NH4NO3 bằng:
![]()
b) Khối lượng của thành phần đủ dinh dưỡng bón cho tới ruộng rau củ là:
Trong 80 gam NH4NO3 đem 28 gam N
Trong 250 gam NH4NO3 đem x gam N => ![]()
Bài 7: Tính bộ phận Xác Suất (theo khối lượng) của những thành phần chất hóa học xuất hiện trong số thích hợp hóa học sau:
a) Fe(NO3)2, Fe(NO3)3
b) N2O, NO, NO2
Gợi ý đáp án
a) MFe(NO3)2 = 56 + 14.2 + 16.3.2 = 180
%Fe = 56/180 .100% = 31,11%
%N = 28/180 .100% = 15,56%
%O = 100% - 31,11% - 15,56% = 53,33%
MFe(NO3)3 = 56 + 14.2 + 16.3.3 = 228
%Fe = 56/228 .100% = 24,56%
%N = 28/228 .100% = 12,28%
%O = 100% - 24,56% - 12,28% = 63,16%
Bài 8: Một thích hợp hóa học đem bộ phận những thành phần theo gót lượng là: 40% Cu; 20% S và 40%O. Xác quyết định công thức chất hóa học của hóa học cơ. sành thích hợp hóa học đem lượng mol là 160g/mol.
Gợi ý đáp án
Trong 1 mol thích hợp hóa học (M = 160 gam/mol) thì:
mCu = 160.40% = 64 gam => nCu = 64:64 = 1mol
mS = 160.20% = 32 gam => nS = 32:32 = 1 mol
mO = 160.40% = 64 gam => nO = 64:16 = 4 mol
Vậy công thức của thích hợp hóa học là CuSO4
Bài 9: Hãy tìm hiểu công thức chất hóa học của hóa học X đem lượng mol MX = 170 (g/mol), bộ phận những thành phần theo gót khối lượng: 63,53% Ag; 8,23% N, còn sót lại O.
Gợi ý đáp án
mN = 8,23.170/100 = 14 gam => nN = 14/14 = 1mol
mAg = 63,53.170/100 = 108 gam => nAg = 108/108 = 1mol
Số gam của O
%O = 100% - (63,53% + 8,23%) = 28,24%
mO = 28,24.170/100 = 48 gam => nO = 48/16 = 3 mol
Trong 1 phân tử thích hợp bên trên có: 1mol nguyên vẹn tử N và 3 mol nguyên vẹn tử O, 1 mol nguyên vẹn tử Ag.
Công thức chất hóa học của thích hợp hóa học bên trên là AgNO3
Bài 10: Lập công thức chất hóa học của thích hợp hóa học A biết:
Phân khối của thích hợp hóa học là 160 đvC
Trong thích hợp hóa học đem 70% theo gót lượng Fe, còn sót lại là oxi.
Gợi ý đáp án
%O = 100% - 70% = 30%
=> mO = 30.160/100 = 48 gam => nO = 48/16 = 3 mol
mFe = 70.160/100 = 112 gam => nFe = 2 mol
Trong 1 phân tử thích hợp bên trên có: 2mol nguyên vẹn tử Fe và 3 mol nguyên vẹn tử O.
Công thức chất hóa học của thích hợp hóa học bên trên là Fe2O3
10. Bài tập luyện áp dụng tự động luyện tập
Câu 1. Cho lếu kim loại tổng hợp loại Mg và Fe nhập H2SO4 loãng dư. Sau phản xạ , nhận được 2,016 lít khí (đktc). Nếu cho tới lếu thích hợp này tính năng với FeSO4 dư thì lượng sắt kẽm kim loại tăng 1,68g. Tính lượng từng sắt kẽm kim loại nhập lếu thích hợp .
Câu 2. Cho 7,8 gam lếu thích hợp nhì sắt kẽm kim loại là Mg và Al tính năng với hỗn hợp H2SO4 loãng, dư. Khi phản xạ kết thúc giục, người tao nhận được 8,96 lít khí (đktc). Tính lượng từng sắt kẽm kim loại nhập lếu thích hợp thuở đầu.
Câu 3. Hòa tan 2,8 gam một sắt kẽm kim loại R đem hóa trị II bởi vì một lếu thích hợp bao gồm 80 ml hỗn hợp H2SO4 0,5M và 200 ml hỗn hợp HCl 0,2M nhận được hỗn hợp A và V lít khí H2 (ở đktc). Để hòa hợp hỗn hợp A thì nên cần 100 ml hỗn hợp KOH 0,2M. Phát biểu này tiếp sau đây về vấn đề bên trên là ko đúng?
Câu 4. Cho lếu thích hợp bao gồm Fe và Cu nhập hỗn hợp AgNO3 cho tới Khi những phản xạ xẩy ra trọn vẹn, nhận được hỗn hợp X bao gồm nhì muối hạt và hóa học rắn Y bao gồm nhì sắt kẽm kim loại. Hai muối hạt nhập X là
Câu 5. Cho lếu thích hợp bao gồm 0,02 mol Mg và 0,03 mol Al tính năng với V ml hỗn hợp chứa chấp Cu(NO3)2 0,2M và AgNO3 0,1M. Sau phản xạ nhận được hỗn hợp Y và lếu kim loại tổng hợp loại Z. Cho toàn cỗ lếu thích hợp Z tính năng với hỗn hợp HCl dư nhận được 0,336 lít khí H2 (đktc). Cho biết những phản xạ xẩy ra trọn vẹn. Giá trị của V là bao nhiêu?
Xem thêm: ngày xuân con én đưa thoi
Câu 6. Hòa tan không còn 17,05 gam lếu thích hợp Al và Zn cần thiết một vừa hai phải đầy đủ 124,1 gam hỗn hợp HCl 25% nhận được hỗn hợp muối hạt và khí ko color. Xác quyết định Xác Suất lượng Zn nhập lếu thích hợp đầu.
Câu 7. Hòa tan 18,4 gam Fe, Cu nhập hỗn hợp HCl dư nhận được 2,24 lít khí (đktc) nhận được hỗn hợp muối hạt và 1 hóa học rắn ko tan. Phần trăm lượng Cu nhập lếu thích hợp đầu là bao nhiêu?
Câu 8. Hoà tan 10 gam lếu thích hợp 2 muối hạt cacbonat của kịm loại hoá trị II và III bởi vì hỗn hợp HCl, tao nhận được hỗn hợp X và 0,672 lít khí cất cánh đi ra (ở đktc). Tính lượng muối hạt nhận được Khi cô cạn hỗn hợp X.









Bình luận