NaCl Là Chất Điện Li Mạnh Hay Yếu? Điều này tiếp tục được yukenfucoidan giải đáp vô nội dung bài viết tại đây. Mời độc giả nằm trong theo gót dõi và dò thám hiểu!
NaCl, hoặc hay còn gọi là natri clorua, là 1 trong những ăn ý Hóa chất phổ cập, được nghe biết với tên thường gọi không xa lạ là muối hạt ăn. NaCl với công thức phân tử là NaCl, với lượng phân tử là 58,44 g/mol.
Bạn đang xem: nacl là chất điện li mạnh hay yếu
NaCl với dạng cơ vật lý là tinh ma thể white color, ko hương thơm, tan chất lượng tốt nội địa và những dung môi phân cực kỳ không giống.
NaCl có rất nhiều phần mềm vô cuộc sống thường ngày, như thực hiện phụ gia, bảo vệ đồ ăn, điều tiết nước vô khung người, phát hành những hóa hóa học khác ví như natri hydroxit, clo, natri cacbonat…
NaCl Là Chất Điện Li Gì?

Để vấn đáp thắc mắc NaCl là hóa học năng lượng điện li gì, tao cần thiết hiểu định nghĩa hóa học năng lượng điện li là gì. Chất năng lượng điện li là hóa học Lúc tan nội địa hoặc dung môi phân cực kỳ không giống, những phân tử hòa tan bị phân li trở nên những ion dương và âm. Các ion này còn có tài năng dẫn năng lượng điện vô hỗn hợp. Chất năng lượng điện li được tạo thành nhì loại: hóa học năng lượng điện li mạnh và hóa học năng lượng điện li yếu hèn.
Chất năng lượng điện li mạnh là hóa học Lúc tan nội địa, những phân tử hòa tan phân li trọn vẹn trở nên những ion. Những hóa học năng lượng điện li mạnh thông thường là những axit mạnh (như HCl, HNO3, H2SO4…), những bazơ mạnh (như NaOH, KOH, Ca(OH)2…) và đa số những muối hạt (như NaCl, KCl, KNO3…).
Chất năng lượng điện li yếu hèn là hóa học Lúc tan nội địa, chỉ tồn tại một phần nhỏ những phân tử hòa tan phân li trở nên những ion, phần rộng lớn vẫn không thay đổi dạng phân tử. Những hóa học năng lượng điện li yếu hèn thông thường là những axit yếu hèn (như CH3COOH, HF, H2CO3…), những bazơ yếu hèn (như NH3, CH3NH2…) và một trong những muối hạt không nhiều tan (như AgCl, PbSO4…).
NaCl Là Chất Điện Li Mạnh Hay Yếu?

Dựa bên trên khái niệm bên trên, tao hoàn toàn có thể tóm lại rằng NaCl là hóa học năng lượng điện li mạnh. Lý vì thế là vì như thế NaCl hoàn toàn có thể tan trọn vẹn nội địa và những phân tử hòa tan đều bị phân li trở nên những ion âm và dương, là ion Na+ và Cl-.
Nếu vô hỗn hợp với 99 phân tử NaCl hòa tan thì cả 99 phân tử đều phân li đi ra ion

Phương trình năng lượng điện li của NaCl nội địa được viết lách như sau:
NaCl → Na+ + Cl-
cũng có thể thấy rằng vô hỗn hợp NaCl không hề tồn bên trên phân tử NaCl nào là. Như vậy không giống với tình huống của những hóa học năng lượng điện li yếu hèn, ví như HF (axit fluorhydric).
HF Lúc tan nội địa chỉ tồn tại một lượng nhỏ những phân tử HF phân li trở nên ion H+ và F-, còn sót lại vẫn không thay đổi dạng HF. Phương trình năng lượng điện li của HF nội địa được viết lách như sau:
HF ⇌ H+ + F-
cũng có thể thấy rằng vô hỗn hợp HF vẫn còn đấy tồn bên trên phân tử HF, và phương trình năng lượng điện li là thuận nghịch ngợm, Có nghĩa là phản xạ phân li hoàn toàn có thể xẩy ra theo gót cả hai phía.
Tại Sao NaCl Là Chất Điện Li Mạnh?

Để phân tích và lý giải tại vì sao NaCl là hóa học năng lượng điện li mạnh, tao cần thiết xét cho tới những nguyên tố sau:
- Bản hóa học của link chất hóa học vô phân tử NaCl.
- Sự tương tác Một trong những ion Na+ và Cl- với phân tử nước.
- Độ tan của NaCl nội địa.
Bản Chất Của Liên Kết Hóa Học Trong Phân Tử NaCl
NaCl là 1 trong những ăn ý hóa học ion, Có nghĩa là những vẹn toàn tử Na và Cl kết phù hợp với nhau bằng phương pháp trao thay đổi electron. Nguyên tử Na với số electron phần bên ngoài nằm trong là 1 trong những, vẹn toàn tử Cl với số electron phần bên ngoài nằm trong là 7.
Xem thêm: thể loại văn học dân gian ra đời ở đông nam á thời cổ trung đại là
Khi Na và Cl phối kết hợp, vẹn toàn tử Na tiếp tục nhường nhịn electron phần bên ngoài nằm trong cho tới vẹn toàn tử Cl, kể từ cơ tạo nên ion Na+ và ion Cl-. Các ion này có khả năng sẽ bị hấp dẫn cùng nhau vì như thế lực bú Coulomb, tạo nên trở nên link ion.

Liên kết ion vô NaCl với điểm lưu ý là cực mạnh, vì như thế sự chênh chênh chếch năng lượng điện Một trong những ion là rất rộng lớn. Như vậy thực hiện cho những ion khó khăn bị tách thoát ra khỏi nhau vô hiện trạng rắn.
Tuy nhiên, Lúc NaCl tan nội địa, những phân tử nước tiếp tục can thiệp vô link ion, thực hiện hạn chế sự hấp dẫn Một trong những ion và tạo nên những ion hydrat. Như vậy dẫn tới việc phân li trọn vẹn của NaCl vô hỗn hợp.
Sự Tương Tác Giữa Các Ion Na+ Và Cl- Với Phân Tử Nước
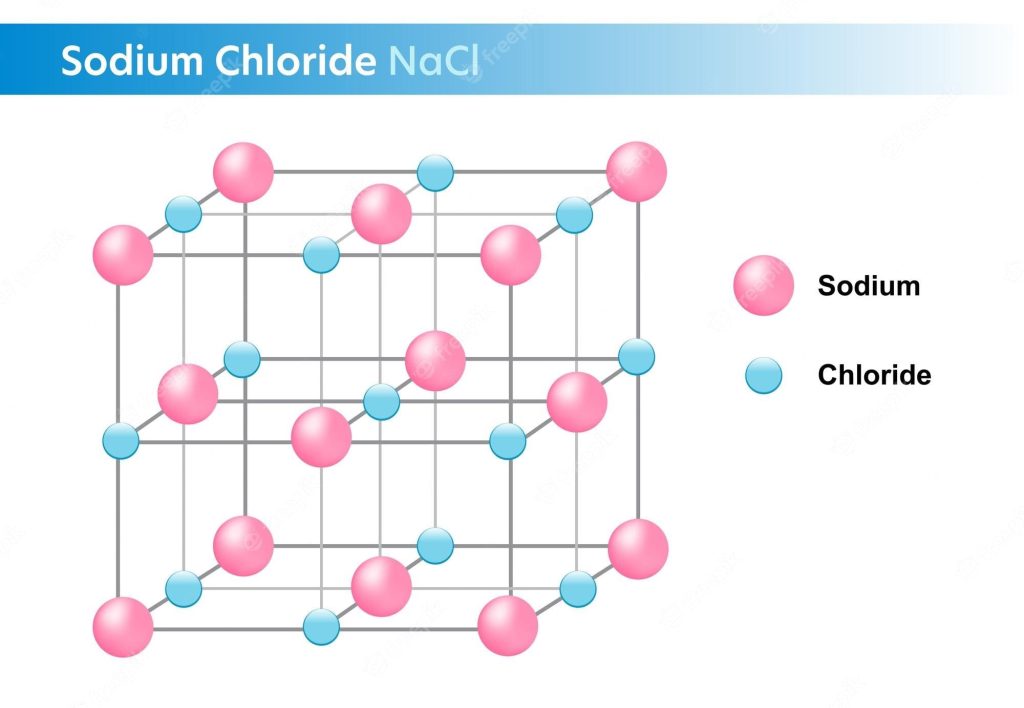
Nước là 1 trong những dung môi phân cực kỳ, Có nghĩa là những phân tử nước với sự phân bổ ko đồng đều của năng lượng điện. Phân tử nước với nhì vẹn toàn tử hiđro và một vẹn toàn tử oxy, được phối kết hợp vì như thế link nằm trong hóa trị.
Do oxy có tính âm năng lượng điện cao hơn nữa hiđro, nên oxy tiếp tục bú electron về phía bản thân, tạo nên năng lượng điện âm bên trên oxy và năng lượng điện dương bên trên hiđro.
Như vậy thực hiện cho tới phân tử nước với 1 đầu đem năng lượng điện âm và một đầu đem năng lượng điện dương.
Khi NaCl tan nội địa, những phân tử nước tiếp tục xung quanh những ion Na+ và Cl-, tạo nên những ion hydrat. Các ion hydrat là những ion được quấn vì như thế một tờ phân tử nước. Các phân tử nước tiếp tục bố trí sao cho tới đầu đem năng lượng điện ngược vết với ion ở trung tâm.
Ví dụ, ion Na+ sẽ tiến hành xung quanh vì như thế những phân tử nước với đầu oxy (mang năng lượng điện âm) thiên về trung tâm. Ion Cl- sẽ tiến hành xung quanh vì như thế những phân tử nước với đầu hiđro (mang năng lượng điện dương) thiên về trung tâm.
Độ Tan Của NaCl Trong Nước
Độ tan của NaCl nội địa là 1 trong những nguyên tố cần thiết nhằm xác lập NaCl là hóa học năng lượng điện li mạnh hoặc yếu hèn. Độ tan của NaCl nội địa được ấn định lượng vì như thế hằng số tan (Ksp), là tích mật độ của những ion vô hỗn hợp bão hòa. Công thức tính Ksp của NaCl là:
Ksp = [Na+][Cl-]

Trong số đó, [Na+] và [Cl-] là mật độ mol/lít của những ion Na+ và Cl- vô hỗn hợp bão hòa.
Độ tan của NaCl nội địa là cực kỳ cao, khoảng tầm 35,7 g/100 ml ở 20°C. Như vậy Có nghĩa là NaCl hoàn toàn có thể tan được thật nhiều nội địa, tạo nên hỗn hợp với mật độ ion cao. Ksp của NaCl ở 25°C là 36,1 g/100 ml, tương tự với 5,4 x 10^-2 mol/lít. Như vậy đã cho thấy rằng NaCl với Ksp rất rộng lớn, và bởi vậy là hóa học năng lượng điện li mạnh.
Xem thêm: 2m bằng bao nhiêu cm
trái lại, những hóa học năng lượng điện li yếu hèn thông thường có tính tan thấp nội địa, và bởi vậy với Ksp nhỏ. Ví dụ, AgCl (muối bạc clorua) là 1 trong những hóa học năng lượng điện li yếu hèn, vì như thế Lúc tan nội địa chỉ tồn tại một lượng nhỏ những phân tử AgCl phân li trở nên ion Ag+ và Cl-, còn sót lại vẫn không thay đổi dạng kết tinh ma.
Độ tan của AgCl nội địa cực kỳ thấp, chỉ tầm 0,002 g/100 ml ở 25°C. Ksp của AgCl ở 25°C là 1 trong những,8 x 10^-10 mol/lít, tương tự với cùng một,3 x 10^-5 mol/lít. Như vậy đã cho thấy rằng AgCl với Ksp cực kỳ nhỏ, và bởi vậy là hóa học năng lượng điện li yếu hèn.
Trên đấy là những vấn đề trả lời về thắc mắc NaCl Là Chất Điện Li Mạnh Hay Yếu? yukenfucoidan Hy vọng nội dung bài viết này của tôi hữu ích với chúng ta.











Bình luận