Phản ứng lão hóa khử là gì? Ví dụ về phản xạ lão hóa khử lớp 10? Đây là nhị thắc mắc nhưng mà chúng ta học viên gửi về mang đến VIETCHEM tối đa vô tuần vừa mới qua. Chính vì vậy, ngày thời điểm hôm nay tất cả chúng ta tiếp tục nằm trong dò xét hiểu xoay xung quanh chủ thể phản xạ lão hóa khử vô nội dung bài viết tiếp sau đây.
1. Phản ứng lão hóa khử là gì?
Phản ứng lão hóa khử là một trong những phản xạ chất hóa học đem sự gửi electron Một trong những hóa học nhập cuộc vô phản xạ. Hiểu một cơ hội giản dị, đấy là phản xạ khiến cho một vài yếu tắc thay cho thay đổi số lão hóa.
Bạn đang xem: phản ứng oxi hoá khử
Chất khử, hóa học lão hóa vô phản xạ lão hóa - khử
Phản ứng này bao gồm đem những hóa học sau:
- Chất khử (nhường electron)
- Chất oxy hóa
- Quá trình nhường nhịn electron (oxi hóa)
- Quá trình nhận electron (khử)
Ví dụ phản xạ lão hóa sau: Fe + CuSO4 -> Cu + FeSO4
Quá trình thay cho thay đổi số oxi hóa: Fe0 → Fe2+ + 2e, FCu2+ + 2e → Cu0
Trong phản xạ này, những hóa học nhập vai trò như sau:
- Nguyên tử Fe là hóa học khử (sự lão hóa nguyên vẹn tử sắt)
- Số lão hóa của đồng hạn chế kể từ +2 xuống 0 (ion đồng là hóa học oxi hóa)
=> Kết luận: Phản ứng này được gọi là phản xạ lão hóa – khử vì thế tồn bên trên mặt khác về việc lão hóa và sự khử.
2. Dấu hiệu phân biệt phản xạ lão hóa khử là gì?
Quá trình quang quẻ ăn ý của cây trái cũng là một trong những phản xạ lão hóa - khử
>>>XEM THÊM: Thành phần kết cấu nguyên vẹn tử là gì?
Thành phần kết cấu nguyên vẹn tử là gì?
Phản ứng lão hóa khử vô đời sống được thể hiện tại trải qua quy trình thở của thực vật. Chúng hít vào khí cacbonic, giải hòa oxi và một loạt những quy trình trao thay đổi không giống.
Sự nhen cháy nhiên liệu trong những mô tơ, những quy trình năng lượng điện phân, những phản xạ xẩy ra vô pin đều là quy trình lão hóa khử
Ngoài đi ra, một loạt những quy trình tạo ra luyện kim, hóa học mềm, dược phẩm, phân bón chất hóa học,.. đều là biểu lộ của sự việc lão hóa - khử.
3. Các bước viết lách phương trình phản xạ lão hóa khử
3 bước thăng bằng phương trình lão hóa - khử
Bước 1: Trước tiên rất cần được xác lập được số lão hóa của những yếu tắc nhằm xác lập hóa học này là lão hóa hóa học này là khử.
Bước 2: Thực hiện tại viết lách phương trình lão hóa và quy trình khử, thăng bằng phương trình phản ứng
Bước 3: Ghi thông số của những hóa học lão hóa và hóa học khử vô sơ trang bị phản xạ và thăng bằng phương trình.
4. Các phản xạ lão hóa khử
- Phản ứng lão hóa - khử thông thường: Phản ứng lão hóa tiếp tục tồn bên trên ở nhị phân ử những hóa học không giống nhau
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O
Cu + 2H2SO4 đặc → CuSO4 + SO2 + 2H2O
- Phản ứng lão hóa - khử nội phân: Phản ứng nhưng mà những hóa học khử và hóa học lão hóa khử nằm trong phụ thuộc 1 phân tử tuy nhiên ở cả hai nguyên vẹn tử không giống nhau
AgNO3 → Ag + NO2 + O2
Cu(NO3)2 → CuO + NO2 + O2
- Phản ứng lão hóa - khử tự động nhiên: Phản ứng này hóa học khử cũng mặt khác là hóa học oxi hóa
Cl2 + 2KOH → KCl + KClO + H2O
4KClO3 → 3KClO4 + KCl
5. Ví dụ về phản xạ lão hóa khử lớp 10

Ví dụ hóa học khử, hóa học oxi vô phản xạ lão hóa - khử
5.1. Ví dụ vô phản xạ lão hóa khử Al + HNO3
Trong phương trình phản xạ lão hóa - khử Al + HNO3 hãy xác lập số lão hóa của những nguyên vẹn tử thay cho đổi
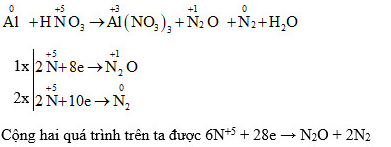
5.2. Ví dụ vô phản xạ lão hóa khử KMnO4
Trong phương trình phản xạ lão hóa - khử KMnO4 + HCl, hãy xác lập số lão hóa của những nguyên vẹn tử thay cho thay đổi.
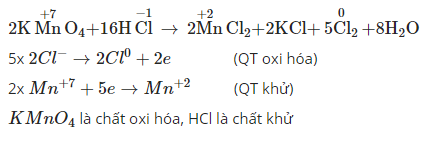
5.3. Ví dụ vô phản xạ lão hóa khử Cu + H2SO4
Trong phương trình phản xạ lão hóa - khử Cu + H2SO4, hãy xác lập số lão hóa của những nguyên vẹn tử thay cho thay đổi.

6. 5 Bài phản xạ lão hóa khử lớp 10

Giải bài bác tập luyện phản xạ lão hóa khử hóa 10
Bài tập luyện 1: Cho những phương trình phản xạ tại đây, hãy xác lập đâu là phản xạ lão hóa khử
Xem thêm: tả cảnh quê hương em
A: 2HgO 2Hg + O2
B: CaCO3CaO + CO2
C: 2Al(OH)3Al2O3+ 3H2O
D: 2NaHCO3Na2CO3+ CO2+ H2O
Lời Giải: Đáp án thực sự A, những đáp án không giống ko nên phản xạ lão hóa khử.
2HgO 2Hg + O2.
Hg2+ + 2e → Hg0
2O2- → O2 + 4e
Bài tập luyện 2: Cho những phương trình phản xạ tại đây, hãy xác lập ở phản xạ này NH3 nhập vai trò là hóa học khử
A: 4NH3+ 5O2→ 4NO + 6H2O.
B: 2NH3 + 3Cl2→ N2+ 6HCl.
C: 2NH3 + 3CuO → 3Cu + N2+ 3H2O.
D: 2NH3 + H2O2+ MnSO4→ MnO2+ (NH4)2SO4.
Lời Giải: Đáp án thực sự D, vì thế N không bao giờ thay đổi số lão hóa trước và sau phương trình phản ứng
Bài tập luyện 3: Cho những phương trình phản xạ tại đây, hãy xác lập phản xạ này là phản xạ lão hóa -khử
A: HNO3 + NaOH → NaNO3 + H2O.
B: N2O5+ H2O → 2HNO3.
C: 2HNO3+ 3H2S → 3S + 2NO + 4H2O.
D: 2Fe(OH)3 → Fe2O3+ 3H2O.
Lời Giải: Đáp án đúng là C, những đáp án không giống ko nên phản xạ lão hóa khử.
Bài tập luyện 4: Thế này là phản xạ lão hóa - khử, mang đến 3 ví dụ
Lời Giải: Phản ứng lão hóa khử là phản xạ chất hóa học vô bại đem sự quy đổi electron giữa những hóa học vô phản ứng
Ví dụ:
H2 + Cl2 -> 2HCl
Fe + 2HCl -> FeCl + H2
FeCl2 + Cl2 -> 2FeCl3
Bài tập luyện 5: Phải cần thiết từng nào gam đồng nhằm khử trọn vẹn lượng ion bạc đem vô 85ml hỗn hợp AgNO3 0,15M.
Lời Giải:
VAgNO3 = 85 ml = 85/1000 lít
-> Cm = n/V => n = (0,15 x 85)/1000 = 0,01275 mol
Phương trình phản ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Theo phương trình tao có:
nCu = ½ nAgNO3 = 0,01275/2 = 0,006375 mol
Xem thêm: điểm chuẩn đại học nha trang 2022
Vậy mCu = 0,006375 x 64 = 0,408g.
Ngoài đi ra, còn thật nhiều dạng bài bác phản xạ lão hóa khử lớp 10 nâng lên không giống, tùy vào cụ thể từng đề bài bác nhưng mà tất cả chúng ta thể hiện phương án thích hợp.
Hy vọng rằng, với những share một vừa hai phải rồi về phản xạ lão hóa khử là gì? Ví dụ về phản xạ lão hóa khử lớp 10 và một vài bài bác tập luyện thông thường gặp gỡ bên trên phía trên sẽ hỗ trợ mang đến chúng ta học viên áp dụng vô thực hiện bài bác tập luyện hiệu suất cao nhất. Tham khảo thêm thắt những dạng bài bác tập luyện chất hóa học không giống bên trên trang web dichvuseotop.edu.vn. Hãy share nội dung bài viết nếu khách hàng thay cho hoặc và thú vị.











Bình luận