I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
Các thành phần nhập bảng tuần trả được bố trí theo hướng tăng dần dần của năng lượng điện phân tử nhân nguyên vẹn tử.
II. CẤU TẠO BẢNG TUẦN HOÀN
1. Ô nguyên vẹn tố
Bạn đang xem: bảng tuần hoàn hóa học lớp 9
- Ô thành phần mang đến biết: Số hiệu nguyên vẹn tử, kí hiệu chất hóa học, thương hiệu thành phần, nguyên vẹn tử khối của thành phần bại.
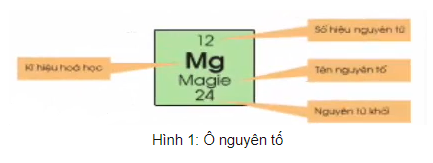
- Số hiệu nguyên vẹn tử có số trị ngay số đơn vị chức năng năng lượng điện phân tử nhân và ngay số electron nhập nguyên vẹn tử. Số hiệu nguyên vẹn tử trùng với số trật tự dù nhập bảng tuần trả.
Ví dụ: Ô loại 11, xếp thành phần natri (Na).
Ta có:
+ Số hiệu nguyên vẹn tử = số proton = số electron = 11
+ Kí hiệu hóa học: Na
+ Tên nguyên vẹn tố: natri
+ Nguyên tử khối: 23
2. Chu kì
- Chu kỳ là mặt hàng những thành phần nhưng mà nguyên vẹn tử của bọn chúng đem nằm trong số lớp electron và được xếp theo hướng năng lượng điện phân tử nhân tăng dần dần.
- Số trật tự chu kì bằng số lớp electron.
- Bảng tuần trả bao gồm đem 7 chu kỳ: chu kỳ luân hồi 1, 2, 3 là những chu kỳ luân hồi nhỏ. Chu kỳ 4, 5, 6, 7 là những chu kỳ luân hồi rộng lớn.
Ví dụ: chu kì 3: chính thức là sắt kẽm kim loại kiềm Na và kết đốc là khí trơ: Ar (agon)
- Nhóm gồm những thành phần nhưng mà nguyên vẹn tử của bọn chúng đem số electron phần ngoài nằm trong cân nhau, vì thế đem đặc thù tương tự động nhau được xếp trở nên một cột theo hướng tăng của năng lượng điện phân tử nhân nguyên vẹn tử.
- Số trật tự của những nhóm A ngay số electron ở phần ngoài nằm trong của nguyên vẹn tử nhập group bại.
Ví dụ:
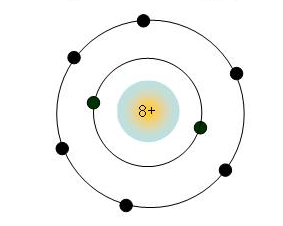
+ Nhóm IA: Gồm những thành phần sắt kẽm kim loại sinh hoạt mạnh. Nguyên tử của bọn chúng đều có một electron ở phần ngoài nằm trong. Điện tích phân tử nhân tăng kể từ Li (3+), … cho tới Fr (87+).
+ Mô phỏng cấu trúc nguyên vẹn tử Kali ở group IA, có một electron ở phần ngoài cùng:
III. SỰ BIỂN ĐỔI TÍNH CHẤT CỦA CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
1. Trong một chu kì
- Trong một chu kỳ luân hồi, Lúc chuồn từ trên đầu cho tới cuối chu kỳ luân hồi theo hướng tăng của năng lượng điện phân tử nhân:
+ Số e phần ngoài cùng của nguyên vẹn tử tăng dần dần từ là 1 cho tới 8 electron.
+ Tính kim loại của những nguyên vẹn tố giảm dần, đồng thời tính phi kim của những thành phần tăng dần dần.
Ví dụ:
Xem thêm: phép vua thua lệ làng
Chu kì 2 bao gồm 8 nguyên vẹn tố:
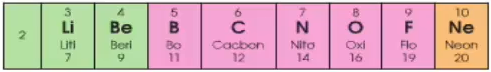
+ Số e phần ngoài nằm trong của nguyên vẹn tử những thành phần nhập chu kỳ luân hồi 2 tăng dần dần từ là 1 cho tới 8
+ Đẩu chu kỳ luân hồi 2 là một trong sắt kẽm kim loại mạnh (Li), cuối chu kỳ luân hồi là một trong phi kim mạnh (F), kết đốc chu kỳ luân hồi là một trong khí khan hiếm (Ne).
2. Trong một nhóm
Trong một group, Lúc chuồn kể từ bên trên xuống bên dưới theo hướng tăng của năng lượng điện phân tử nhân.
- Số lớp electron của nguyên vẹn tử tăng dần dần.
- Tính kim loại của những nguyên vẹn tố tăng dần, đồng thời tính phi kim của những thành phần tách dần dần.
Ví dụ: Nhóm IA bao gồm 6 thành phần từ Li đến Fr
+ Số lớp electron tăng dần dần kể từ 2 cho tới 7. Số electron phần ngoài nằm trong của nguyên vẹn tử đều vày 1.
+ Tính sắt kẽm kim loại của những thành phần tăng dần dần. Đầu group IA, Li là sắt kẽm kim loại sinh hoạt chất hóa học mạnh cuối group là sắt kẽm kim loại Fr sinh hoạt chất hóa học cực kỳ mạnh
IV. Ý NGHĨA CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. hiểu địa điểm của thành phần tớ rất có thể tư duy cấu trúc nguyên vẹn tử và đặc thù của thành phần.
Ví dụ:
Biết: Nguyên tố A đem số hiệu nguyên vẹn tử là 17, chu kì 3, group VIIA.
Xác ấn định được:
+ Nguyên tố A đem số hiệu nguyên vẹn tử là 17, suy đi ra năng lượng điện phân tử nhân của nguyên vẹn tử A là 17+, nguyên vẹn tử A đem 17 electron.
+ A ở chu kì 3, suy đi ra nguyên vẹn tử A đem 3 lớp electron. Vì ở ngay sát cuối chu kì 3 nên A là một trong phi kim mạnh, tính phi kim của A mạnh rộng lớn của thành phần trước nó nhập nằm trong chu kì (là S đem số hiệu là 16).
+ A ở group VIIA nên phần ngoài nằm trong đem 7 electron, tính phi kim của A yếu hèn rộng lớn của thành phần phía bên trên nó nhập nằm trong group (là F đem số hiệu nguyên vẹn tử là 9) tuy nhiên mạnh rộng lớn thành phần đứng bên dưới nó nhập nằm trong group (là Br đem số hiệu nguyên vẹn tử là 35).
2. hiểu cấu trúc nguyên vẹn tử của thành phần rất có thể tư duy địa điểm và đặc thù thành phần bại.
Ví dụ:
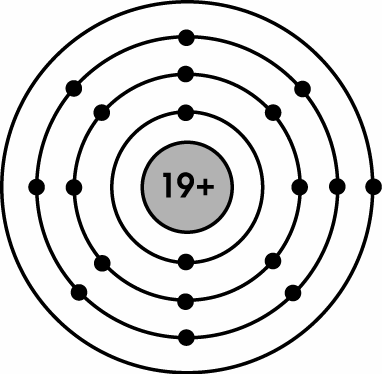
Biết: Nguyên tố X đem năng lượng điện phân tử nhân là 11+, nguyên vẹn tử X đem 3 lớp electron, phần ngoài nằm trong có một electron.
Xác ấn định được:
+ Nguyên tử X đem năng lượng điện phân tử nhân là 11+ suy đi ra X ở dù 11
+ Nguyên tử X đem 3 lớp electron nên X ở chu kỳ luân hồi 3
+ Nguyên tử X đem 1e ở phần ngoài nằm trong nên X ở group IA.
Xem thêm: quá trình hô hấp của cây diễn ra khi nào
- Nguyên tố X là sắt kẽm kim loại vì như thế ở đầu chu kì
Sơ đồ gia dụng tư duy: Sơ lược về bảng tuần trả những thành phần hoá học











Bình luận