Phản ứng lão hóa khử là gì? Ví dụ về phản xạ lão hóa khử lớp 10? Đây là nhị thắc mắc tuy nhiên chúng ta học viên gửi về mang đến VIETCHEM tối đa vô tuần vừa mới qua. Chính vì vậy, ngày thời điểm hôm nay tất cả chúng ta tiếp tục nằm trong dò la hiểu xoay xung quanh chủ thể phản xạ lão hóa khử vô nội dung bài viết tiếp sau đây.
1. Phản ứng lão hóa khử là gì?
Phản ứng lão hóa khử là 1 phản xạ chất hóa học đem sự đem electron trong những hóa học nhập cuộc vô phản xạ. Hiểu một cơ hội giản dị, đấy là phản xạ khiến cho một vài yếu tắc thay cho thay đổi số lão hóa.
Bạn đang xem: phản ứng oxi hóa khử là gì
Chất khử, hóa học lão hóa vô phản xạ lão hóa - khử
Phản ứng này bao gồm đem những hóa học sau:
- Chất khử (nhường electron)
- Chất oxy hóa
- Quá trình nhường nhịn electron (oxi hóa)
- Quá trình nhận electron (khử)
Ví dụ phản xạ lão hóa sau: Fe + CuSO4 -> Cu + FeSO4
Quá trình thay cho thay đổi số oxi hóa: Fe0 → Fe2+ + 2e, FCu2+ + 2e → Cu0
Trong phản xạ này, những hóa học vào vai trò như sau:
- Nguyên tử Fe là hóa học khử (sự lão hóa vẹn toàn tử sắt)
- Số lão hóa của đồng hạn chế kể từ +2 xuống 0 (ion đồng là hóa học oxi hóa)
=> Kết luận: Phản ứng này được gọi là phản xạ lão hóa – khử vì như thế tồn bên trên bên cạnh đó về việc lão hóa và sự khử.
2. Dấu hiệu nhận thấy phản ứng oxi hóa khử là gì?
Quá trình quang đãng phù hợp của cây cối cũng là 1 phản xạ lão hóa - khử
>>>XEM THÊM: Thành phần cấu trúc vẹn toàn tử là gì?
Thành phần cấu trúc vẹn toàn tử là gì?
Phản ứng lão hóa khử vô đời sống được thể hiện tại trải qua quy trình thở của thực vật. Chúng hít vào khí cacbonic, giải tỏa oxi và một loạt những quy trình trao thay đổi không giống.
Sự nhen nhóm cháy nhiên liệu trong số mô tơ, những quy trình năng lượng điện phân, những phản xạ xẩy ra vô pin đều là quy trình lão hóa khử
Ngoài đi ra, một loạt những quy trình tạo ra luyện kim, hóa học mềm, dược phẩm, phân bón chất hóa học,.. đều là biểu thị của sự việc lão hóa - khử.
3. Các bước ghi chép phương trình phản xạ lão hóa khử
3 bước thăng bằng phương trình lão hóa - khử
Bước 1: Thứ nhất rất cần phải xác lập được số lão hóa của những yếu tắc nhằm xác lập hóa học này là lão hóa hóa học này là khử.
Bước 2: Thực hiện tại ghi chép phương trình lão hóa và quy trình khử, thăng bằng phương trình phản ứng
Bước 3: Ghi thông số của những hóa học lão hóa và hóa học khử vô sơ vật dụng phản xạ và thăng bằng phương trình.
4. Các phản xạ lão hóa khử
- Phản ứng lão hóa - khử thông thường: Phản ứng lão hóa tiếp tục tồn bên trên ở nhị phân ử những hóa học không giống nhau
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O
Cu + 2H2SO4 đặc → CuSO4 + SO2 + 2H2O
- Phản ứng lão hóa - khử nội phân: Phản ứng tuy nhiên những hóa học khử và hóa học lão hóa khử nằm trong tuỳ thuộc 1 phân tử tuy nhiên ở cả hai vẹn toàn tử không giống nhau
AgNO3 → Ag + NO2 + O2
Cu(NO3)2 → CuO + NO2 + O2
- Phản ứng lão hóa - khử tự động nhiên: Phản ứng này hóa học khử cũng bên cạnh đó là hóa học oxi hóa
Cl2 + 2KOH → KCl + KClO + H2O
4KClO3 → 3KClO4 + KCl
5. Ví dụ về phản xạ lão hóa khử lớp 10

Ví dụ hóa học khử, hóa học oxi vô phản xạ lão hóa - khử
5.1. Ví dụ vô phản xạ lão hóa khử Al + HNO3
Trong phương trình phản xạ lão hóa - khử Al + HNO3 hãy xác lập số lão hóa của những vẹn toàn tử thay cho đổi
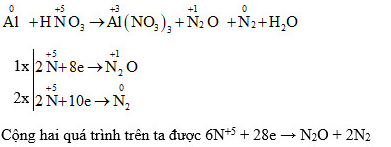
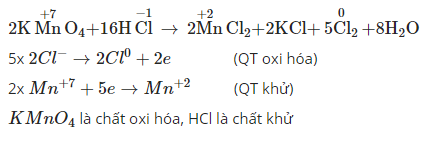
5.2. Ví dụ vô phản xạ lão hóa khử KMnO4
Trong phương trình phản xạ lão hóa - khử KMnO4 + HCl, hãy xác lập số lão hóa của những vẹn toàn tử thay cho thay đổi.
5.3. Ví dụ vô phản xạ lão hóa khử Cu + H2SO4
Trong phương trình phản xạ lão hóa - khử Cu + H2SO4, hãy xác lập số lão hóa của những vẹn toàn tử thay cho thay đổi.
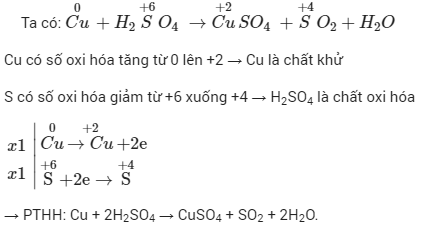
6. 5 Bài phản xạ lão hóa khử lớp 10

Giải bài xích luyện phản xạ lão hóa khử hóa 10
Bài luyện 1: Cho những phương trình phản xạ tại đây, hãy xác lập đâu là phản xạ lão hóa khử
Xem thêm: if parents bring up a child
A: 2HgO 2Hg + O2
B: CaCO3CaO + CO2
C: 2Al(OH)3Al2O3+ 3H2O
D: 2NaHCO3Na2CO3+ CO2+ H2O
Lời Giải: Đáp án thực sự A, những đáp án không giống ko cần phản xạ lão hóa khử.
2HgO 2Hg + O2.
Hg2+ + 2e → Hg0
2O2- → O2 + 4e
Bài luyện 2: Cho những phương trình phản xạ tại đây, hãy xác lập ở phản xạ này NH3 vào vai trò là hóa học khử
A: 4NH3+ 5O2→ 4NO + 6H2O.
B: 2NH3 + 3Cl2→ N2+ 6HCl.
C: 2NH3 + 3CuO → 3Cu + N2+ 3H2O.
D: 2NH3 + H2O2+ MnSO4→ MnO2+ (NH4)2SO4.
Lời Giải: Đáp án thực sự D, vì thế N bất biến số lão hóa trước và sau phương trình phản ứng
Bài luyện 3: Cho những phương trình phản xạ tại đây, hãy xác lập phản xạ này là phản xạ lão hóa -khử
A: HNO3 + NaOH → NaNO3 + H2O.
B: N2O5+ H2O → 2HNO3.
C: 2HNO3+ 3H2S → 3S + 2NO + 4H2O.
D: 2Fe(OH)3 → Fe2O3+ 3H2O.
Lời Giải: Đáp án đúng là C, những đáp án không giống ko cần phản xạ lão hóa khử.
Bài luyện 4: Thế này là phản xạ lão hóa - khử, mang đến 3 ví dụ
Lời Giải: Phản ứng lão hóa khử là phản xạ chất hóa học vô bại liệt đem sự quy đổi electron giữa những hóa học vô phản ứng
Ví dụ:
H2 + Cl2 -> 2HCl
Fe + 2HCl -> FeCl + H2
FeCl2 + Cl2 -> 2FeCl3
Bài luyện 5: Phải cần thiết từng nào gam đồng nhằm khử trọn vẹn lượng ion bạc đem vô 85ml hỗn hợp AgNO3 0,15M.
Lời Giải:
VAgNO3 = 85 ml = 85/1000 lít
-> Cm = n/V => n = (0,15 x 85)/1000 = 0,01275 mol
Phương trình phản ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Theo phương trình tao có:
nCu = ½ nAgNO3 = 0,01275/2 = 0,006375 mol
Xem thêm: muốn tính diện tích hình bình hành
Vậy mCu = 0,006375 x 64 = 0,408g.
Ngoài đi ra, còn thật nhiều dạng bài xích phản xạ lão hóa khử lớp 10 nâng lên không giống, tùy vào cụ thể từng đề bài xích tuy nhiên tất cả chúng ta thể hiện phương án thích hợp.
Hy vọng rằng, với những share vừa phải rồi về phản ứng oxi hóa khử là gì? Ví dụ về phản xạ lão hóa khử lớp 10 và một vài bài xích luyện thông thường bắt gặp bên trên trên đây sẽ hỗ trợ mang đến chúng ta học viên áp dụng vô thực hiện bài xích luyện hiệu suất cao nhất. Tham khảo tăng những dạng bài xích luyện chất hóa học không giống bên trên trang web dichvuseotop.edu.vn. Hãy share nội dung bài viết nếu như khách hàng thay cho hoặc và thú vị.











Bình luận